Invoering van UDI-eisen met modulaire en flexibele technologie
Gezien de miljardenverliezen aan inkomsten als gevolg van namaak en productomleiding per jaar, is de invoering van de UDI-eisen op internationaal niveau een broodnodige stap om de risico's op fraude te beperken en de gegevensstroom en transparantie tussen alle relevante belanghebbenden over de grenzen heen te verbeteren.
Ondanks de uitdagingen op korte termijn waarmee fabrikanten van hulpmiddelen worden geconfronteerd, zoals aanzienlijke nalevingskosten en organisatorische complexiteit, kunnen het systeem voor unieke identificatie van hulpmiddelen (UDI) en de traceerbaarheid van medische hulpmiddelen op lange termijn voordelen opleveren door de beperking van namaak, het voorkomen van parallelle invoer en een betere gegevenscontrole en -transparantie.
Whitepaper: toekomstbestendige naleving: een mondiaal perspectief op unieke identificatiecodering
Snelle toegang tot productinformatie, verbetering van terugroepmanagement en van bescherming tegen vervalsing en grijze markten - Unieke Identificatiecodering (UDI) van medische hulpmiddelen zal naar verwachting een radicale verandering teweegbrengen in de industrie voor medische hulpmiddelen. Tegelijkertijd roept het meerdere vragen op en veroorzaakt het diverse zorgen bij fabrikanten en etiketteerders. Het is belangrijk om het mondiaal perspectief niet uit het oog te verliezen en daarbij de UDI-ontwikkelingen en -veranderingen nauwlettend te volgen.
Kom meer te weten over de uitdagingen en succesfactoren van UDI-implementatie vanuit mondiaal perspectief in deze whitepaper. Dit document biedt een globaal overzicht van de meest recente ontwikkelingen op internationaal niveau voor fabrikanten en etiketteerders. Het is daarom een waardevolle bron van informatie voor fabrikanten en etiketteerders die internationaal actief zijn.
De grondbeginselen van het EU-systeem voor Unieke Identificatie van Hulpmiddelen (UDI)
Om te voldoen aan de UDI-eisen en de daaraan verbonden uitvoeringsdata, doorlopen bedrijven in de medische hulpmiddelensector de implementatiefase, waarbij de verpakkingslijnen worden geactualiseerd met nieuwe technologie en aanvullende IT-oplossingen worden geïntegreerd. Volgens de Europese MDR en IVDR zijn de fabrikanten van medische hulpmiddelen volledig verantwoordelijk voor de uitvoering van de volgende stappen:
Toekenning van UDI's aan afzonderlijke producten
Op enkele uitzonderingen na wordt aan elk medisch hulpmiddel dat op de markt wordt gebracht een Unieke Identificatiecode (UDI) toegekend die bestaat uit de volgende gegevens:
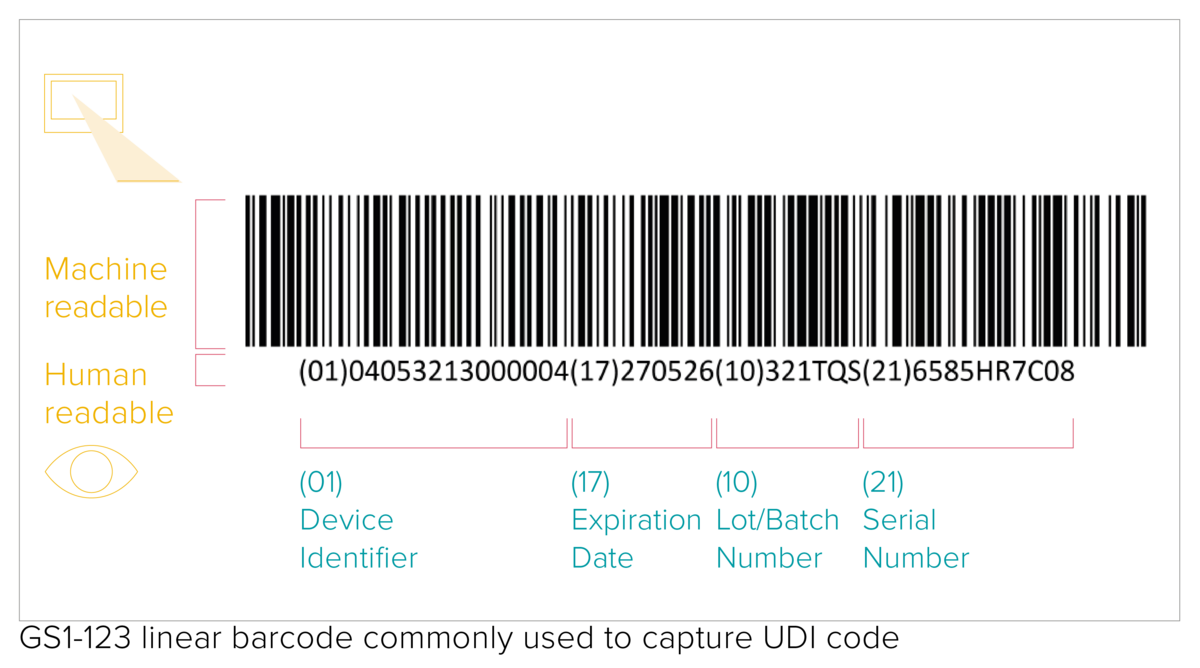
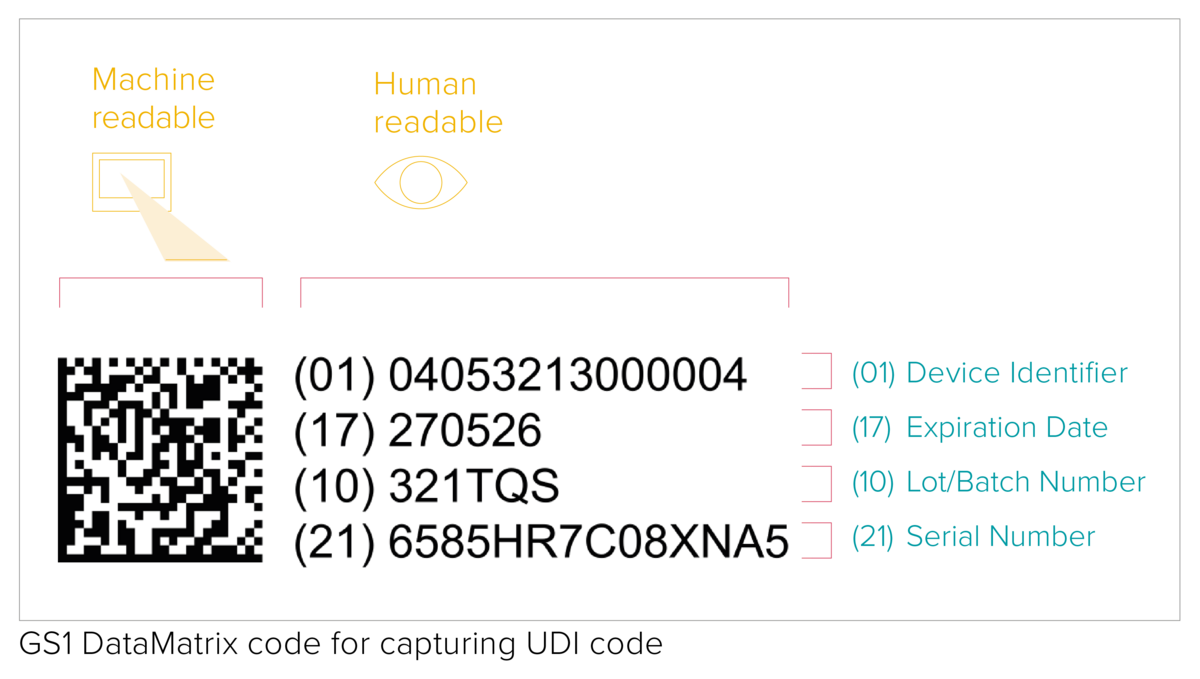
- een Device Identifier (UDI-DI), een uniek productnummer met vaste informatie over de fabrikant en het hulpmiddel;
- een Production Identifier (UDI-PI), productie-identificatie met variabele productiegegevens, zoals serienummer of lotnummer, productiedatum en expiratiedatum.
UDI-eisen verplichten fabrikanten echter niet om UDI-DI-gegevens te genereren, aangezien ze die ontvangen van een van de bevoegde afgifte-instanties - GS1, HIBCC, ICCBBA of IFA - die ze vrij kunnen kiezen.
Het plaatsen van de UDI-code op een product en zijn verpakking
De UDI-code omvat een machineleesbare (AIDC) en een menselijk leesbare (HRI) code. AIDC (Automated Identification for Data Capture) staat voor geautomatiseerde identificatie voor gegevensvastlegging en kan een lineaire barcode zijn of een DataMatrix, enz. Zoals bepaald in de UDI-eisen moet de UDI-code bij herbruikbare producten rechtstreeks op het hulpmiddel worden aangebracht of op het label en alle hogere verpakkingsniveaus.
De afdrukkwaliteit van de barcode is afhankelijk van een aantal verschillende factoren die verband houden met de kwaliteit en opslagcondities van de verpakkingsmaterialen. Alhoewel er geen specifieke UDI-eisen zijn voor barcodeverificatie, verlangt GS1 naleving van de ISO/IEC-verificatiestandaarden om ervoor te zorgen dat de barcode leesbaar is voor alle belanghebbenden uit de toeleveringsketen.
Registreren en actualiseren van UDI-gegevens in EUDAMED
EUDAMED, een geactualiseerde interoperabele Europese database voor het verzamelen, vernieuwen en uitwisselen van gegevens over medische hulpmiddelen, gaat dienst doen als een toegangspunt voor regelgevende instanties, economische actoren, zorgverleners en het publiek.
Inachtneming van de UDI-nalevingstermijn
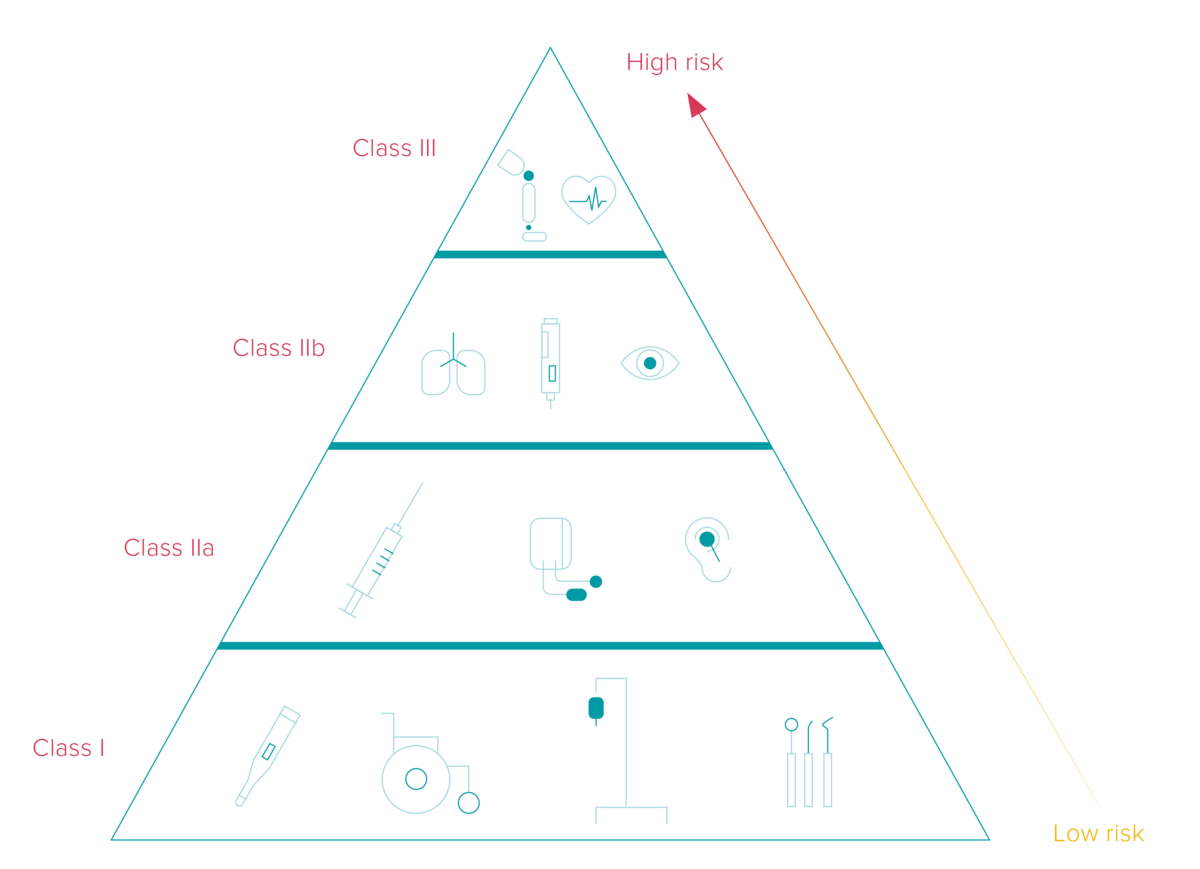
De deadlines voor UDI-implementatie variëren op basis van de classificatie van medische en invitro diagnostische hulpmiddelen in drie verschillende categorieën overeenkomstig hun risiconiveau. Verder hangt de termijn af van de locatie waar de fabrikant de UDI-code aanbrengt: rechtstreeks op het hulpmiddel of op het label.
Wilt u meer te weten komen over de UDI-eisen voor fabrikanten van medische hulpmiddelen?
UDI-eisen vanuit mondiaal perspectief
Om de traceerbaarheid van medische hulpmiddelen mogelijk te maken en productomleiding en -vervalsing te voorkomen, was de VS het eerste land dat een wereldwijd UDI-systeem invoerde voor medische hulpmiddelen die op de Amerikaanse markt werden gedistribueerd.
De UDI-eisen van de FDA zijn grotendeels gebaseerd op de richtlijnen van het International Medical Device Regulators Forum (IMDRF) met een gecentraliseerde nationale database, GUDID, die dient als openbare referentiecatalogus voor producten die met UDI zijn gecodeerd.
Het belang van een unieke hulpmiddelenidentificatie is ook erkend door veel landen in de opkomende markten, zoals China, India, Brazilië, Zuid-Korea, Saoedi-Arabië en Taiwan om er maar een paar te noemen. Deze wereldwijde ontwikkeling heeft een rechtstreekse impact op de wijze waarop internationale fabrikanten hun producten markeren en hun UDI-gegevensstromen in verschillende landen beheren.
Ondanks de inspanningen van het IMDRF om de UDI-eisen wereldwijd te helpen standaardiseren, verschillen ze van land tot land op een aantal punten. Deze verschillen kunnen de volgende aspecten omvatten:
- Geaccepteerde typen UDI-dragerformaten
- Markering en plaatsing van de UDI-code op het product en de verpakking
- UDI-DI en UDI-PI gegevenseisen
- Uitvoeringstermijnen voor verschillende productgroepen
- Gebeurtenissen die actualisatie van UDI-gegevens vereisen
- Productgroepen die zijn onderworpen aan de UDI-eisen in verschillende landen
Deze aspecten hebben een belangrijke impact op de keuze van een oplossing voor UDI-naleving. Een oplossing die, gezien de ontwikkeling van de mondiale regelgeving, zeer toepasbaar, toekomstbestendig en flexibel moet zijn.
Serialisatie van medische hulpmiddelen
Hoewel van fundamenteel belang voor elk efficiënt systeem voor de traceerbaarheid van medische hulpmiddelen, is serialisatie ook een UDI-eis voor actieve implanteerbare hulpmiddelen, zoals pacemakers, defibrillatoren en implanteerbare glucosemonitoren.
Serialisatie staat voor het toekennen van een uniek serienummer aan elk eindproduct, zodat het automatisch kan worden geïdentificeerd op het verkooppunt. De farmaceutische industrie zet serialisatie al in als anti-vervalsingsmaatregel op mondiaal niveau. Deze technologie wint ook in andere sectoren aan kracht.
Zelfs bedrijven waarvan de producten niet onder de categorie van actieve implanteerbare apparaten vallen, zullen profiteren van het uitrusten van hun lijnen met flexibele technologie die zowel UDI-conformiteit als serialisatie mogelijk maakt. Deze aanpak helpt hen om hun productielijnen toekomstgericht te maken voor het geval dat serialisatie een dwingende UDI-eis wordt voor meer productgroepen of in bepaalde importerende landen verplicht gesteld wordt.
Aggregatie van medische hulpmiddelen
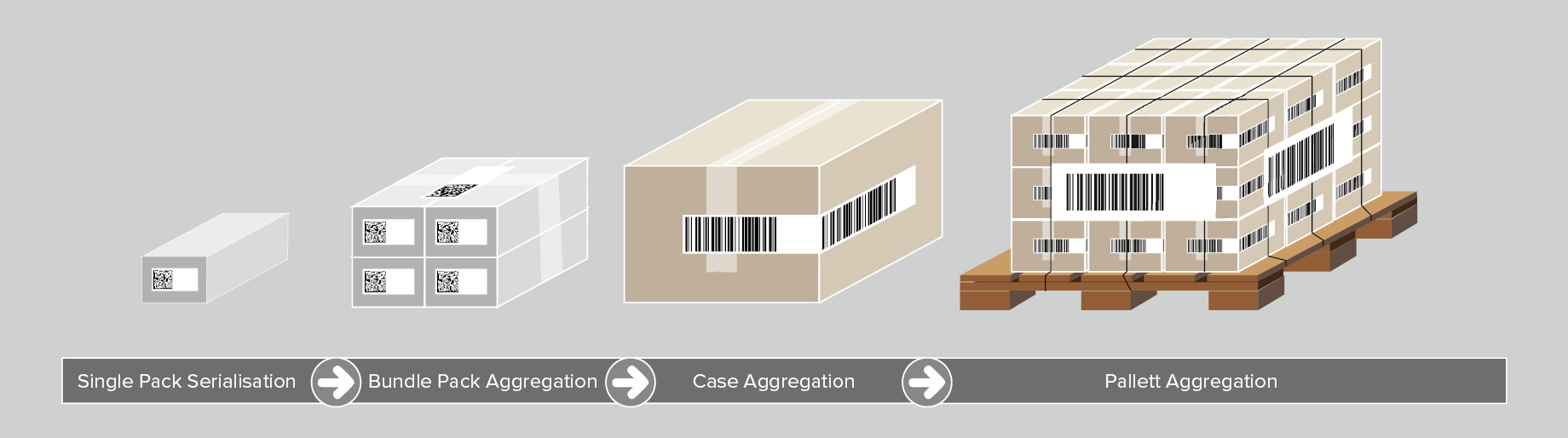
Hoewel niet verplicht volgens UDI-eisen, is aggregatie van medische hulpmiddelen een andere pijler van optimale traceerbaarheid van medische hulpmiddelen. Aggregatie verwijst naar het creëren van een “parent-child”-hiërarchie tussen verschillende niveaus van productverpakkingen, beginnend bij een producteenheid tot aan een pallet. Om bijvoorbeeld meerdere producteenheden samen te voegen tot een verzenddoos, worden de volgende stappen ondernomen:
- Voor elk product wordt een UDI-barcode gescand;
- De barcodegegevens worden geaggregeerd en gekoppeld aan de verzenddoos;
- De verzenddoos krijgt een label met een UDI-barcode inclusief een uniek serienummer.
Dit proces kan worden herhaald voor alle verpakkingsniveaus. Bij het scannen van een code ontvangt de operator alle UDI-gegevens die betrekking hebben op de medische hulpmiddelen die in de verzenddoos zitten.
Voordelen van aggregatie bij het terugroepen van producten
Productaggregatie verbetert niet alleen de traceerbaarheid van medische hulpmiddelen, maar kan ook het terugroepen, corrigeren of verwijderen van producten optimaliseren. Als het terugroepen of de terugname van een product onvermijdelijk is, zijn de fabrikanten verplicht om de hele partij of batch van het product op alle locaties uit de circulatie te nemen.
Aangezien aggregatie van medische hulpmiddelen leidt tot “parent-child”-hiërarchieën tussen de verschillende verpakkingsniveaus, kunnen producten doelgerichter en zelfs per eenheid uit de handel worden genomen. Dit betekent dat producten kunnen worden teruggeroepen of teruggenomen op basis van serienummers in plaats van lot- of batchnummers. Deze nieuwe optie leidt tot een sneller en doelgerichter proces van het terugroepen of uit de handel nemen van producten.
Heeft u vragen over aggregatie van medische hulpmiddelen?
UDI-technologie voor traceerbaarheid van medische hulpmiddelen
De TQS-oplossingen van Wipotec maken UDI-naleving effectief mogelijk en bieden toegevoegde waarde dankzij meerdere aanvullende opties. Afhankelijk van diverse aspecten van het productie- en verpakkingsproces kunnen fabrikanten kiezen voor stand-alone machines of OEM-kits. Beide oplossingen zorgen voor een betrouwbare uitvoering:
- UDI-conforme etikettering of codering van meerdere verpakkingsniveaus. Of het nu gaat om stand-alone of OEM, TQS-apparatuur kan unieke identificatiecodes plaatsen op productlabels en verpakkingsmaterialen. Het is ook mogelijk om UDI's offline af te drukken op platte dozen vóór het verpakken van de hulpmiddelen.
- UDI-barcodeverificatie en klassering. Het TQS-systeem identificeert en weigert producten met barcodes van slechte kwaliteit op betrouwbare wijze om ervoor te zorgen dat alleen leesbare barcodes door de kwaliteitscontrole komen. Daarnaast voert de apparatuur een kwaliteitsklassering uit van elke gedrukte barcode conform de UDI-barcodeverificatie-eisen van GS1. De kwaliteit van de barcodes en de klasseringsgegevens zijn een goed bewijs dat de afgedrukte barcodes voldoen aan de ISO/IEC-kwaliteitsnormen op de plaats van productie.
- Serialisatie en aggregatie van medische hulpmiddelen. TQS-oplossingen zijn multifunctionele modulaire machines die betrouwbare traceerbaarheid van medische hulpmiddelen mogelijk maken. Naast naadloze interoperabiliteit kunnen de machines autonoom serienummers genereren en toewijzen aan producten en gegevens overbrengen naar het systeem op de locatie.
- Manipulatiebestendige (tamper-evident) verzegeling wordt uitgevoerd na verificatie van de codekwaliteit. Dit is een optionele module die zowel in OEM als stand-alone oplossingen verkrijgbaar zijn. Hoewel dit geen UDI-eis is, zorgen manipulatiebestendige labels voor de integriteit van productverpakkingen.
- Open interfaces en interoperabiliteit. Dankzij open communicatie-interfaces kan TQS-apparatuur UDI-gegevens uitwisselen met elk site-level systeem.
- In-line controleweging is een optioneel onderdeel dat zorgt voor uiterst precieze gewichtscontrole van eindproducten. De uiterste nauwkeurige weegresultaten tonen aan of de eindverpakking alles bevat wat er in zou moeten zitten. Producten met een onjuist gewicht worden geweigerd. Afwijking van het doelgewicht betekent vaak een ontbrekend onderdeel, bijvoorbeeld een bijsluiter.
Stand-alone machines en OEM-kits
Stand-alone machines van Wipotec zijn compacte, aanpasbare en plug-and-play oplossingen voor UDI-conforme codering, serialisatie en aggregatie van medische hulpmiddelen die snel kunnen worden geïntegreerd in verpakkingslijnen. Het portfolio omvat ook off-line oplossingen voor het afdrukken van UDI-codes vóór het verpakken.
TQS OEM-kits bestaan uit meerdere onderdelen, zoals printers, camera's en etiketteermachines. Omdat een OEM-oplossing zowel modulair als flexibel is, kan ze worden geconfigureerd op basis van klantspecifieke vereisten. De OEM-apparatuur wordt geïnstalleerd in een externe machine, waardoor het een voorkeursoptie is in fabrieken met minder ruimte. Als volledig geautomatiseerde oplossing kan TQS OEM zeer hoge productiesnelheden bereiken.
UDI-naleving en nog meer: hefboomeffect van de voordelen van geavanceerde oplossingen
De TQS-technologie voor UDI-naleving is niet alleen intuïtief en eenvoudig te hanteren, maar houdt ook de algehele productiviteit van de verpakkingslijnen op peil. Deze technologie biedt waardevolle slimme functies die de efficiëntie verhogen en tegelijkertijd de fabrikanten helpen om te voldoen aan de UDI-eisen.
Slimme functies van TQS:
- Het centrale lijnmanagement ontlast de machineoperator, omdat hij niet elke machine of de onderdelen ervan afzonderlijk hoeft in te stellen. Alle relevante instellingen worden centraal in de lijnmanager-software geconfigureerd.
- De ConfigureFast-functie maakt een snelle en intuïtieve configuratie en bediening van codeer- en controlecomponenten mogelijk via slechts één gebruikersinterface.
- Open XML-interfaces zorgen voor compatibiliteit met meer dan 80 site-level systemen (L3 + L4) voor gegevensbeheer en -overdracht.
- De TQS Traceability+-functie maakt het verzamelen van aanvullende gegevens mogelijk, zoals de waarde van de klasseringscode en het productgewicht, die op meerdere manieren worden gebruikt om de productiekwaliteit te reproduceren.
- Beveiligde service op afstand via een op firewall gebaseerde VPN-verbinding maakt een snelle service op afstand mogelijk, waardoor machine-uitval en servicekosten worden beperkt.
- Layout Software Interface is een van de nieuwste functies. U kunt hiermee direct vanaf een desktopcomputer lay-outs maken via alle op de markt verkrijgbare software voor extern lay-outbeheer.
Profiteer van de deskundige knowhow van Wipotec
Als toonaangevende internationale leverancier van betrouwbare codering, serialisatie en aggregatie, ondersteunt Wipotec fabrikanten van medische hulpmiddelen op hun pad naar naleving van de UDI-eisen. De technologische expertise van het bedrijf is aangetoond in meer dan 3000 succesvolle Track & Trace-projecten. Als GS1-partner volgt Wipotec de mondiale ontwikkelingen op het gebied van regelgeving en biedt meerdere functies om te voldoen aan de huidige en toekomstige mondiale regelgeving.