Implementazione degli obblighi UDI con tecnologia modulare e flessibile
Considerate le perdite multimilionarie sui ricavi subite ogni anno a causa della falsificazione e contraffazione dei prodotti, il rispetto degli obblighi UDI a livello internazionale è un’azione fondamentale per mitigare i rischi di truffa e per aumentare il flusso di dati e la trasparenza fra tutte le parti interessate, indipendentemente dalla provenienza.
A dispetto delle sfide di breve termine affrontate dai produttori, quali i costi di adeguamento e la complessità organizzativa, il sistema UDI (Unique Device Identification o Identificazione Unica dei Dispositivi) e la tracciabilità dei dispositivi medici hanno il potenziale di portare utili sul lungo periodo, limitando la contraffazione, prevenendo l’importazione parallela e aumentando la trasparenza e il controllo dei dati.
In questa pagina troverete informazioni sui seguenti argomenti:
- Principi fondamentali del sistema europeo per l’identificazione unica dei dispositivi medici (UDI, Unique Device Identification)
- Obblighi UDI da una prospettiva globale
- Tecnologia UDI per la tracciabilità dei dispositivi medici
- Oltre il rispetto della normativa UDI: i vantaggi delle soluzioni all’avanguardia
White paper: Rispetto normativo a prova di futuro: una prospettiva globale sull’identificazione Unica dei Dispositivi (UDI)
Rapido accesso alle informazioni di prodotto, gestione dei richiami migliorata, protezione superiore da contraffazione e mercati grigi - l’Identificazione Unica dei Dispositivi (Unique Device Identification o più semplicemente UDI) è destinata a rivoluzionare l’industria dei dispositivi medici. Al contempo pone però diverse questioni, creando dubbi e preoccupazioni ai produttori e alle aziende specializzate nell’etichettatura. È importante non perdere di vista la prospettiva globale, tenendo a mente tutti gli sviluppi e le modifiche a tema UDI.
Scoprite le sfide legate all’implementazione della normativa UDI e i fattori di successo da una prospettiva globale con questo white paper. Il documento offre una panoramica globale sugli ultimi sviluppi in ambito internazionale per i produttori e le aziende etichettatrici. Come tale, è una fonte preziosa di informazioni per i produttori che operano a livello internazionale e per le aziende specializzate nell’etichettatura.
Principi fondamentali del sistema europeo per l’identificazione unica dei dispositivi medici (UDI, Unique Device Identification)
Con l’obiettivo di rispettare gli obblighi UDI e le relative date di entrata in vigore, le aziende medico-farmaceutiche attraversano una fase di implementazione che prevede l’aggiornamento delle linee di confezionamento con tecnologie nuove e l’integrazione di soluzioni IT aggiuntive. Seguendo i nuovi regolamenti UE MDR (sui dispositivi medici) e IVDR (sui dispositivi medico-diagnostici in vitro), i produttori di dispositivi medici avranno piena responsabilità dei seguenti passaggi:
Assegnare numeri identificativi UDI ai singoli prodotti
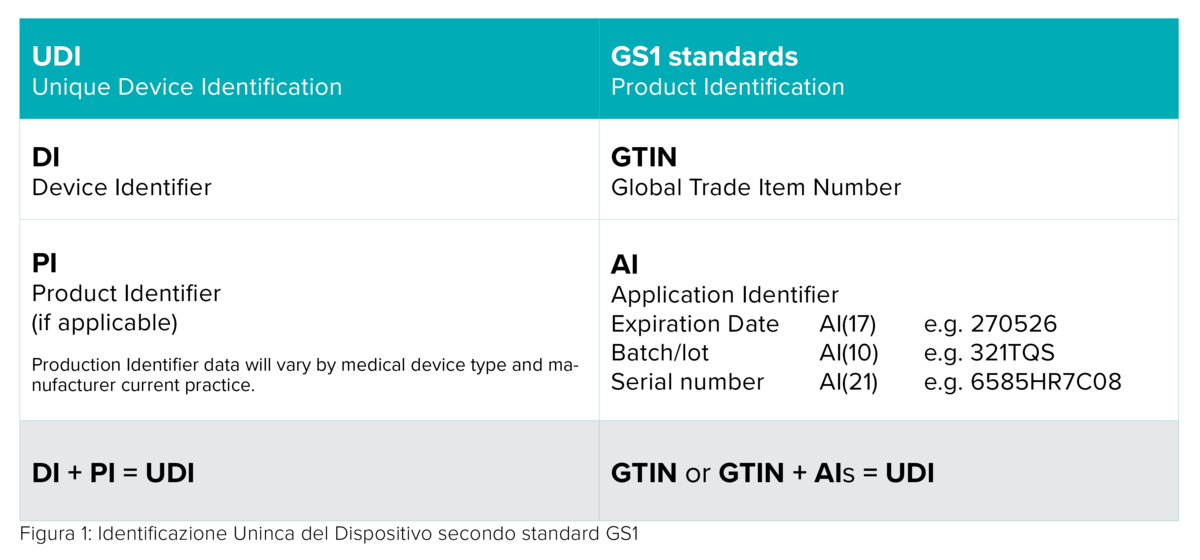
Salvo rare eccezioni, ogni dispositivo medico destinato al mercato dovrà vedersi assegnato un numero identificativo UDI (Unique Device Identifier), inclusivo dei seguenti dati:
- un identificativo di prodotto (Device Identifier UDI-DI) con informazioni fisse sul produttore e sul dispositivo;
- un identificativo della produzione (UDI-PI) con dati di produzione variabili, come numero seriale o numero di lotto, data di produzione e data di scadenza.
Va ricordato però, che la normativa UDI non obbliga i produttori a generare i dati UDI-DI. Quest’ultimi verranno emessi da una delle agenzie autorizzate - GS1, HIBCC, ICCBBA o IFA – che possono essere scelte liberamente.
Posizionare il codice UDI sul prodotto e sulla relativa confezione
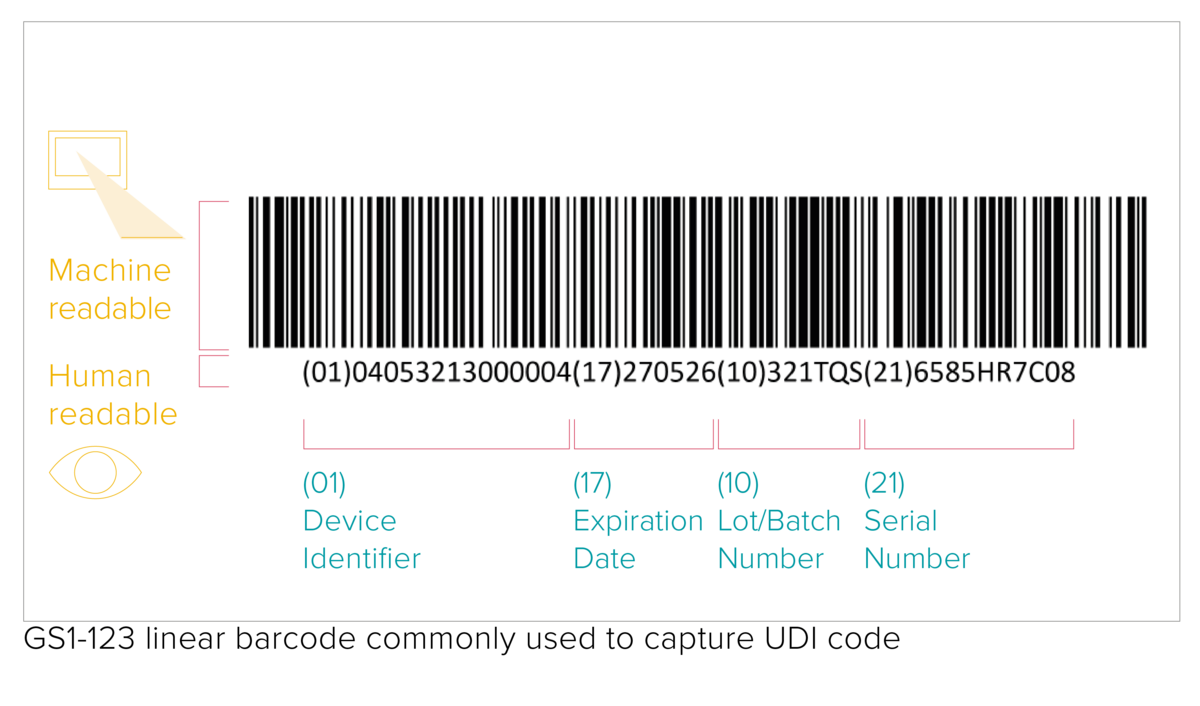
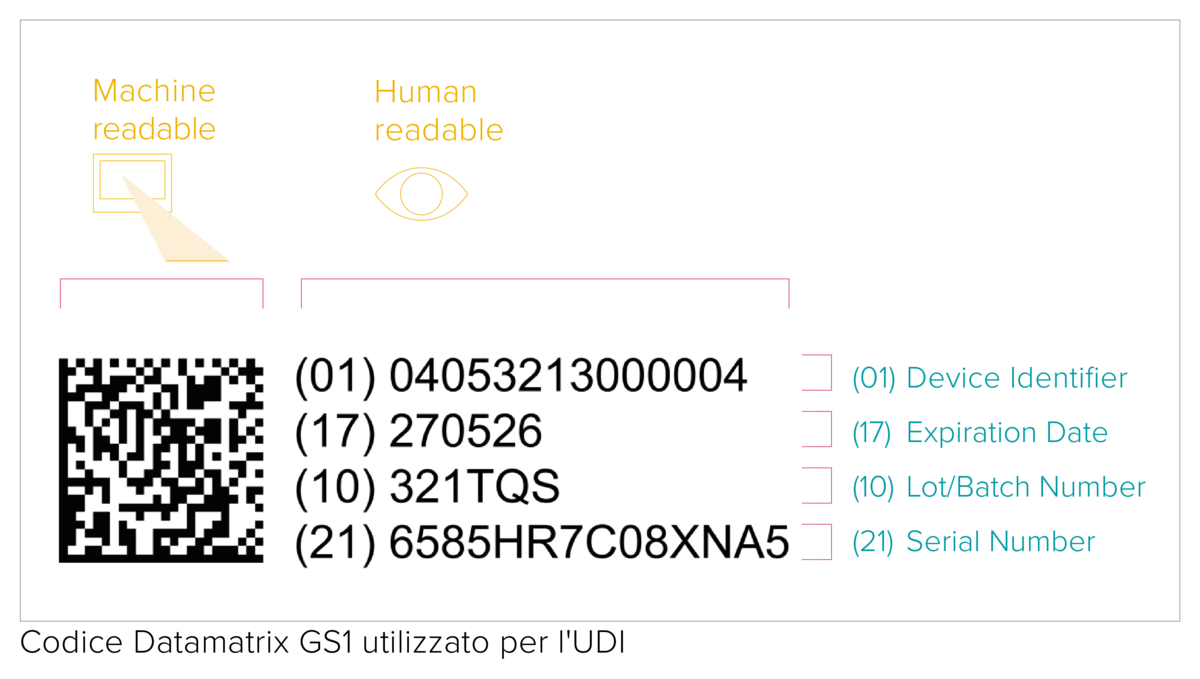
Il codice UDI è composto da un codice a barre (AIDC) leggibile da uno scanner o altra macchina, e anche da un codice alfanumerico leggibile dall’uomo (HRI). Il codice AIDC (Automated Identification for Data Capture, ovvero Identificazione Automatica per la Cattura dei Dati) può essere un codice a barre lineare o un Data Matrix, ecc. Come specificato dal complesso normativo, il codice UDI dovrà essere indicato sul dispositivo medico stesso nel caso di prodotti riutilizzabili o sulla sua etichetta e su tutti gli altri livelli di packaging superiori.
La qualità di stampa del codice a barre dipende da molteplici fattori legati alla qualità e alle condizioni di stoccaggio dei materiali di confezionamento. Anche se non sono presenti requisiti specifici sulla verifica del codice a barre UDI, l’agenzia GS1 richiede l’osservanza degli standard ISO/IEC per assicurare la leggibilità del codice a barre in ogni momento della catena di fornitura.
Registrare e aggiornare i dati UDI su EUDAMED
EUDAMED, una banca dati europea aggiornata e interoperabile, ha l’obiettivo di raccogliere, rinnovare e scambiare informazioni sui dispositivi medici. Un punto di accesso per corpi regolatori, operatori economici, strutture mediche e anche per il pubblico.
Osservare il rispetto delle scadenze in tema UDI
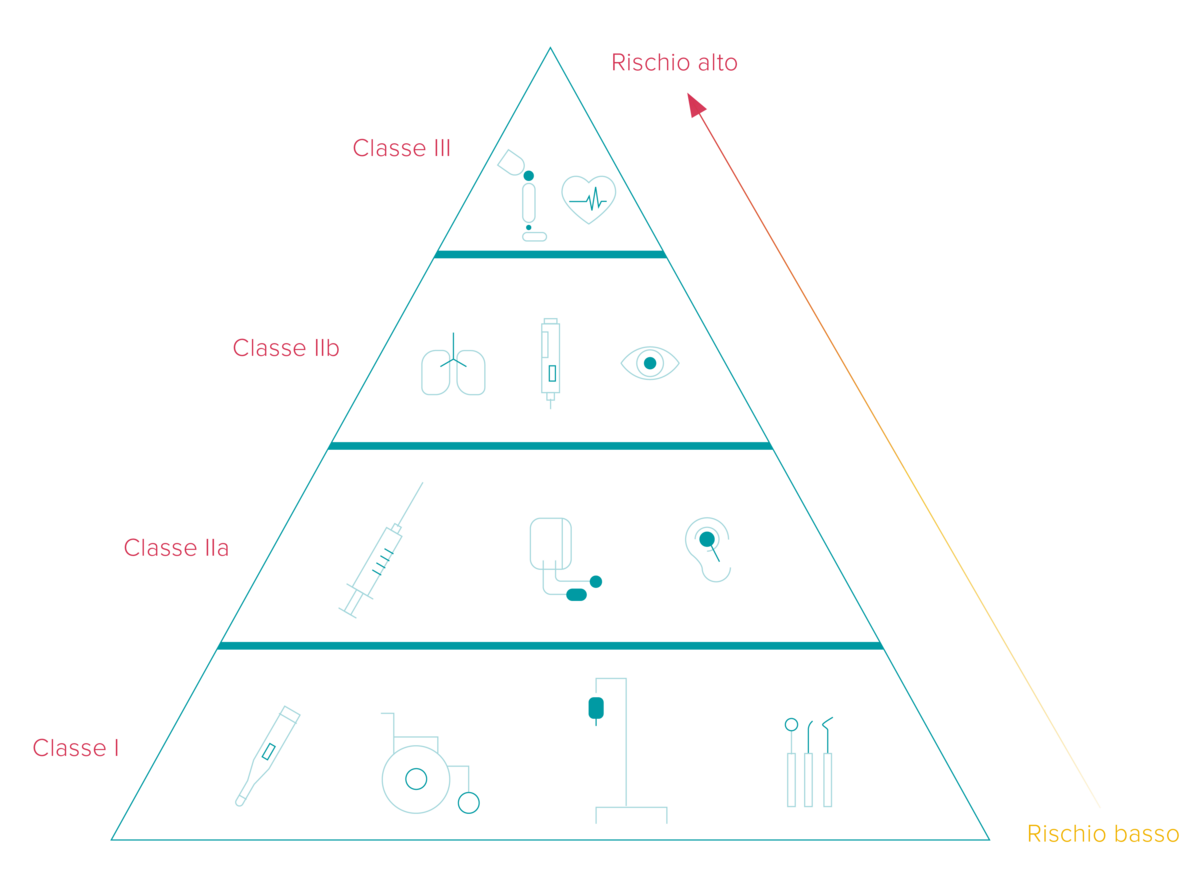
Le scadenze in tema UDI variano a seconda della classificazione dei dispositivi medici e di diagnostica in-vitro in 3 categorie separate, in relazione ai livelli di rischio. Inoltre, la scadenza varia a seconda che il produttore debba inserire il codice UDI sul dispositivo medico o sulla sua etichetta (packaging).
Volete saperne di più sugli obblighi UDI per i produttori di dispositivi medici?
Obblighi UDI da una prospettiva globale
Per giungere alla tracciabilità dei dispositivi medici e prevenire la contraffazione a la diversione, gli Stati Uniti sono stati i primi a introdurre un sistema globale UDI per i dispositivi medici distribuiti nel mercato domestico.
I requisiti UDI della FDA (Food and Drug Administration) sono, per la maggior parte, basati sulle linee guida del Forum internazionale dei regolatori di dispositivi medici (IMDRF) con un database centralizzato nazionale, chiamato GUDID, che svolge la funzione di catalogo pubblico di riferimento per i prodotti con codici UDI.
L’importanza dei codici identificativi unici è stata riconosciuta anche in vari Paesi dei mercati emergenti, fra cui Cina, India, Brasile, Corea del Sud, Arabia Saudita e Taiwan, per citarne alcuni. Questo sviluppo globale ha un impatto diretto sul modo in cui i produttori internazionali marchiano i loro prodotti e gestiscono i flussi di dati UDI attraverso varie zone del mondo.
Nonostante l’impegno dell’IMDRF per favorire la standardizzazione globale degli obblighi UDI, i codici variano da Paese a Paese su vari aspetti. Queste differenze possono includere i seguenti aspetti:
- Tipologie di formati UDI accettate.
- Marchiatura e posizionamento del codice UDI sul prodotto e relativo packaging.
- Obblighi relativi ai dati indicati nei codici UDI-DI e UDI-PI.
- Scadenze variabili a seconda del tipo di prodotto.
- Eventi che innescano un aggiornamento dei dati UDI.
- Gruppi di prodotti sottoposti agli obblighi UDI in vari Paesi.
Questi aspetti hanno un impatto significativo sulla scelta di una soluzione per il rispetto della normativa UDI, considerando la costante evoluzione del quadro regolatorio globale. Le caratteristiche fondamentali di questa soluzione sono alta adattabilità, “future-proofing” e agilità.
Serializzazione dei dispositivi medici
Fondamentale per qualsiasi sistema efficiente di tracciabilità dei dispositivi medici, la serializzazione rientra anche fra gli obblighi UDI sui dispositivi impiantabili attivi, come pacemaker, defibrillatori o glucometri impiantabili.
Serializzazione significa assegnare un numero seriale unico a ciascun prodotto “finito” per poterlo identificare automaticamente in qualsiasi momento del processo di vendita. L’industria farmaceutica sta già applicando misure di serializzazione e anti-contraffazione su scala globale e questa tecnologia sta trovando slancio anche in altri settori.
Anche le aziende che producono o commercializzano prodotti non inclusi nella categoria dei dispositivi impiantabili attivi potranno giovare dell’implementazione sulle loro linee di una tecnologia flessibile che permetta il rispetto della normativa UDI e il raggiungimento della serializzazione. Questo approccio li aiuterà a mantenere sempre all’avanguardia le linee produttive, qualora la serializzazione diventi obbligatoria su altri gruppi di prodotto o in alcuni Paesi importatori.
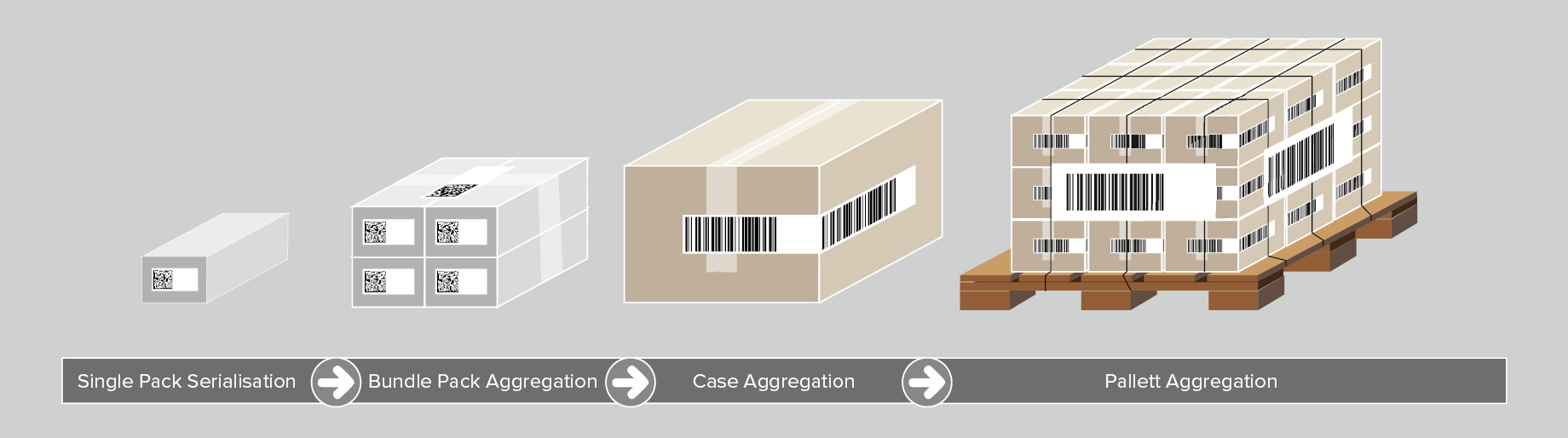
Aggregazione dei dispositivi medici
Pur non essendo obbligatoria ex normativa UDI, l’aggregazione dei dispositivi medici è un altro pilastro della tracciabilità dei dispositivi medici. Aggregazione significa creare una gerarchia padre-figlio fra i vari livelli di confezionamento del prodotto, a partire dal singolo prodotto, salendo fino al pallet. Ad esempio, per aggregare diversi prodotti singoli in una sola confezione di spedizione, vengono affrontati i seguenti passaggi:
- Viene scansionato un codice a barre UDI per ogni prodotto.
- I dati dei codici a barre vengono aggregati e collegati alla confezione di spedizione.
- Il pacchetto riceve la sua etichetta con un codice a barre UDI che include un numero seriale unico.
Questa procedura può essere ripetuta su tutti i livelli di confezionamento. Al momento della scansione di un codice, l’operatore riceve tutte le informazioni UDI relative ai dispositivi medici contenuti nella confezione destinata al mercato.
Vantaggi dell’aggregazione durante i richiami di prodotto
L’aggregazione dei prodotti non migliora solamente la tracciabilità dei dispositivi medici ma può anche ottimizzare la procedura di richiamo, correzione o ritiro di uno o più prodotti. Se il richiamo o il ritiro di un prodotto dal mercato sono inevitabili, i produttori sono tenuti a togliere dalla circolazione tutto il lotto, in ogni sua destinazione.
L’aggregazione dei dispositivi medici crea gerarchie padre-figlio fra tutti i livelli di confezionamento, permettendo il richiamo o il ritiro dei prodotti sulla base dei numeri seriali invece che dei numeri di lotto (o batch). Questa nuova opzione velocizza sensibilmente il richiamo o il ritiro di prodotti dal mercato.
Avete qualche domanda sull’aggregazione dei dispositivi medici?
Tecnologia UDI per la tracciabilità dei dispositivi medici
Le soluzioni TQS di Wipotec offrono una risposta efficace agli obblighi UDI, fornendo valore aggiunto attraverso una serie di opzioni aggiuntive. A seconda di varie specifiche del processo di produzione e confezionamento, i produttori possono scegliere fra macchinari “stand-alone” o soluzioni in kit OEM integrate. In entrambi i casi sarà possibile:
- Etichettare o codificare nel rispetto dell’UDI su vari livelli di confezionamento. Che si tratti di soluzioni stand-alone o integrate, i macchinari TQS possono imprimere codici identificativi univoci sulle etichette o sulle confezioni dei prodotti. È possibile anche stampare codici UDI sulle scatole smontate, prima di confezionare i dispositivi medici.
- Verificare e valutare i codice a barre UDI. Il sistema TQS è affidabile nell’identificazione e nel rifiuto di codici a barre di scarsa qualità per assicurare che solo i codici a barre leggibili passino il controllo di qualità. In aggiunta, il macchinario valuta la qualità di ogni codice a barre stampato sulla base dei requisiti di verifica dei codici a barre UDI di GS1. I dati sulla qualità del codice a barre e la sua valutazione garantiscono il rispetto degli standard qualitativi ISO/IEC in fase di produzione.
- Serializzare e aggregare i dispositivi medici. Le soluzioni TQS sono macchinari multifunzione e modulari che hanno l’obiettivo di ottenere la tracciabilità affidabile dei dispositivi medici. Oltre alla interoperabilità, i macchinari possono generare autonomamente e assegnare numeri seriali ai prodotti e trasferire i dati al sistema in sito.
- Il sigillo anti-manomissione viene applicato dopo la verifica di qualità del codice. Si tratta di un modulo opzionale, disponibile sia su soluzioni “stand-alone” che integrate. Pur non essendo incluse fra gli obblighi UDI, le etichette anti-manomissione garantiscono l’integrità del packaging del prodotto.
- Interfacce aperte e interoperabilità. Grazie alle interfacce a comunicazione aperta, i macchinari TQS possono scambiare dati UDI con qualsiasi sistema a livello di sito.
- Il controllo del peso su linea è un componente opzionale che permette l’ispezione del peso ad altissima precisione dei prodotti finiti. La precisione dei risultati di pesatura indica se il pacchetto finito contenga o meno tutto ciò che dovrebbe. I prodotti con un peso errato vengono rifiutati. Deviazioni sul peso standard significano spesso la mancanza di un componente come, ad esempio, un foglietto illustrativo.
Macchinari “stand-alone” e kit OEM
I macchinari “stand-alone” di Wipotec sono soluzioni compatte, personalizzabili e pronte all’uso per conformarsi agli obblighi UDI, serializzare e aggregare i dispositivi medici, con una rapida integrazione nelle linee di confezionamento. Sono anche disponibili soluzioni fuori linea (off-line) per stampare i codici UDI prima del confezionamento. .
I kit OEM di TQS sono composti da diversi componenti quali stampanti, videocamere ed etichettatrici. Una soluzione integrata OEM è modulare e flessibile, configurata sulla base delle necessità del cliente. Il kit OEM viene installato su un macchinario di terze parti, l’opzione ideale per gli stabilimenti produttivi con poco spazio disponibile. I kit OEM di TQS sono una soluzione automatizzata al 100%, capace di operare ad altissime velocità di produzione.
Oltre il rispetto della normativa UDI: i vantaggi delle soluzioni all’avanguardia
La tecnologia TQS per il rispetto degli obblighi UDI non è solo intuitiva e facile da utilizzare; mantiene anche la produttività complessiva delle linee di confezionamento e offre funzionalità smart valide per aumentare l’efficienza, aiutando al tempo stesso i produttori a rispettare gli obblighi UDI.
Funzionalità Smart di TQS:
- Il line manager centralizzato solleva il singolo operatore da diverse responsabilità, non dovendo impostare separatamente ogni macchinario o i suoi componenti. Tutte le impostazioni rilevanti vengono configurate centralmente dal software di gestione della linea (line manager).
- ConfigureFast consente configurazioni e operazioni rapide e intuitive, oltre alla codifica e l’ispezione dei componenti, il tutto tramite una sola interfaccia utente.
- Interfacce XML aperte per garantire compatibilità con oltre 80 sistemi a livello di sito (L3 + L4) per la gestione e il trasferimento dei dati.
- La funzione di tracciabilità TQS Traceability+ consente di raccogliere dati aggiuntivi, come la valutazione dei codici a barre e il peso del prodotto, utilizzabili in vario modo per verificare la qualità della produzione.
- Sistema sicuro di assistenza da remoto attraverso una connessione VPN protetta da firewall per un servizio rapido di assistenza da remoto, riducendo i tempi morti e i costi di assistenza.
- L’interfaccia di layout del software è una delle ultime funzionalità aggiunte. Consente la creazione di layout direttamente da un semplice computer desktop attraverso uno qualsiasi dei software esterni di gestione dei layout disponibili sul mercato.
Approfittate del know-how esperto di Wipotec
Fra i leader internazionali nella fornitura di soluzioni affidabili per la codifica, la serializzazione e l’aggregazione, Wipotec aiuta i produttori di dispositivi medici a conformarsi agli obblighi UDI. L’expertise tecnologica dell’azienda è dimostrata da più di 3.000 progetti Track and Trace di successo. Quale partner di GS1, Wipotec segue gli sviluppi normativi globali, fornendo varie funzionalità per rispettare la normativa globale, attuale e futura.