Direttive contro i medicinali falsificati – prevenire lafalsificazione di medicinali
La sicurezza dei medicinali è estremamente importante, ma a causa di medicinali falsificati continua a essere messa in pericolo. Dietro a medicinali falsificati potrebbero nascondersi farmaci con ingredienti dichiarati in modo falso, diluiti o mancanti. Rivenditori e pazienti vengono fuorviati dall'effettivo contenuto per via della confezione apparentemente autentica o di una nuova confezione in scatole originali.
Rispetto ai preparati autentici, i prodotti falsificati di norma vengono realizzati e venduti a prezzi notevolmente più economici. Stando a una stima dell'agenzia americana per gli alimenti e i medicinali FDA (Food and Drug Administration), in tutto il mondo oltre il 10% di tutti i medicinali in circolazione dovrebbe essere falsificato. Le possibili conseguenze sono: Credendo di avere a che fare con giusti medicinali, i pazienti assumono inconsapevolmente sostanze inefficaci se non addirittura dannose correndo il rischio di esporre la propria salute a conseguenze drastiche.
I produttori farmaceutici onesti devono non solo accettare cali di fatturato sulla base della concorrenza low-cost dei prodotti falsificati, ma anche perdite di fiducia da parte dei consumatori che si sentono ingannati. Le direttive contro i medicinali falsificati richieste dall'organizzazione mondiale della sanità, che molti Stati stanno introducendo, sono quindi attese da tempo – e conformarsi rapidamente è nell'interesse di tutti i produttori farmaceutici seri.
Avete bisogno di altre informazioni sulle direttive contro la falsificazione globali? Siamo a disposizione per fornirvi consulenza!
In questa pagina vi informiamo sulle linee guida globali in materia di contraffazione dei farmaci:
- Panoramica mondiale
- UE (2011/62/UE)
- USA (DSCSA)
- Sudafrica
- Russia (legge federale 61-FZ)
- Brasile (SNCM)
- Implementazione della direttiva contro la falsificazione
Direttive contro la falsificazione nel mondo – panoramica
Overview of falsification guidelines worldwide
Legislators all over the world have resolutely opposed the dangers of falsified drugs for consumers and companies by adopting national and supranational falsification directives. Compliance with the regulations enables pharmaceutical manufacturers and packaging service providers to ensure that their products can be distributed seamlessly in the target markets and falsified low-cost products are reliably removed from those markets. There are multiple falsification directives worldwide at various stages of implementation, with partly differing requirements.
In this overview, you will find out where the similarities and peculiarities lie.
- Coding
- Tamper-Evident seal
- Aggregation
- GS1 international
Codifica: Altri Paesi, altre marcature di medicinali
Tutte le direttive contro la falsificazione richiedono un identificatore prodotto individuale nelle confezioni dei medicinali. Oltre a ciò, la maggior parte delle direttive prevedono la data di scadenza del medicinale nonché un numero lotto ed eventualmente un numero di serie. Ma il formato in cui tali marcature devono essere eseguite può variare fortemente. Devono però essere sempre contenuti testo in chiaro leggibile all'uomo nonché un codice a barre leggibile dalla macchina. Lo stesso vale per il tipo di identificatore prodotto – spesso viene imposto il formato GTIN del GS1, occasionalmente viene anche predefinito un numero ID nei formati NTIN o specifici per il Paese (come ad esempio PPN in Germania, CIP in Francia, KDC in Corea, CNK in Belgio, AIC in Italia ecc.). Nell'identificatore prodotto normalmente sono contenute le seguenti informazioni: un prefisso Paese, il codice azienda, l'identificatore articolo e un codice di controllo.
Sigillatura antimanomissione (tamper evident): Particolarità della Direttiva UE contro i medicinali falsificati
La sigillatura antimanomissione viene imposta per i medicinali soggetti a prescrizione nei Paesi che a partire dal 9 febbraio 2019 saranno soggetti alla direttiva UE contro i medicinali falsificati. La sigillatura previene una manomissione a posteriori dei medicinali confezionati o l'occultamento di medicinali falsificati in confezioni originali. Se alla vendita il sigillo risulta danneggiato o aperto, la consegna al cliente non può avvenire.
La soluzione per la sigillatura antimanomissione di scatole di medicinali:
Aggregazione: Track & Trace tra l'intera catena di fornitura
Una aggregazione che consenta la tracciabilità di una singola confezione prodotto per l'intero tragitto di trasporto e tra più livelli di confezionamento è richiesta solo da alcune direttive, ad esempio in Russia o in Turchia. Paesi come gli USA si riservano ancora di decidere, nell'UE e in alcuni altri Paesi l'aggregazione è facoltativa. In Brasile, a partire dal 2021 ogni singola scatola deve essere tracciabile tra i diversi livelli di aggregazione. Anche qui il tipo di codifica potrebbe differire a seconda del Paese. Nonostante l'aggregazione in alcune direttive contro la falsificazione dal punto di vista puramente giuridico sia facoltativa (come sopra detto in quelle europee), potrebbero desiderarla clienti come grossisti e farmacie ospedaliere. Queste contrastano in parte grandi forniture in dimensione pacchetto o pallet - la possibilità di verificare un'intera fornitura direttamente all'entrata merci facilita notevolmente il flusso merce.
Con le nostre soluzioni di aggregazione TQS-CP e TQS-CP Bottle metterete a disposizione dei clienti esattamente ciò. Medicinali verificabili a livello pacchetto e pallet. L'operatore riempe il cartone di spedizione strato per strato. Dopo ogni strato la telecamera integrata rileva i codici delle scatole di medicinali. Una volta che il cartone è riempito e il livello di aggregazione è concluso, la TQS-CP crea automaticamente la giusta etichetta. Ciò funziona su più livelli di aggregazione.
GS1 international – Custode degli identificatori
Il GS1 international stabilito a Bruxelles progetta gli standard globali per diversi settori e assegna un insieme di identificatori prodotto (Global Trade Item Numbers - GTIN) nonché altri identificatori per medicinali. Lo stesso garantisce la comprensione internazionale dei codici a barre standardizzati e degli identificatori. Grazie alla stretta collaborazione di Wipotec con GS1 Germania e con il GS1 Global Healthcare User Group, ai nostri clienti trasmettiamo le novità rapidamente implementando le relative prescrizioni.
La Directiva de falsificación 2011/62/UE y sus implicaciones para los fabricantes de la UE
Nel 2011 è stata divulgata la Direttiva UE contro i medicinali falsificati 2011/62/UE che, dopo un periodo di transizione di 3 anni, a partire da febbraio 2019 si applicherà nell'Unione Europea a tutti i medicinali soggetti a prescrizione e a selezionati farmaci da banco. Anche gli stati non membri UE Islanda e Norvegia sono soggetti alla direttiva contro la falsificazione. Italia, Belgio e Grecia hanno già proceduto alla serializzazione prima di febbraio 2019. Questo però non secondo la direttiva UE, ma con l'ausilio di bollini. Hanno altri sei anni per implementare completamente le direttive UE. I medicinali che dopo la scadenza non avranno le necessarie caratteristiche di sicurezza conformemente alla EU FMD (direttiva contro i medicinali falsificati) non potranno più essere commercializzati nell'UE. Nella pratica, al momento della consegna al paziente la singola confezione verrà scannerizzata dal farmacista. Se dalla scansione emergerà una segnalazione d'errore, il medicinale non potrà essere consegnato.
Avete bisogno di altre informazioni sul FMD-UE?
- identificatore prodotto in formato GTIN, NTIN (oppure PPN per la Germania)
- numero lotto
- data di scadenza
- numero di serie individuale della singola confezione
- eventuali numeri prodotto nazionali per motivi di rimborso tramite casse nazionali (national healthcare reimbursement number, NHRN)
Le singole confezioni devono inoltre essere protette contro la manipolazione con un sigillo antimanomissione intatto.
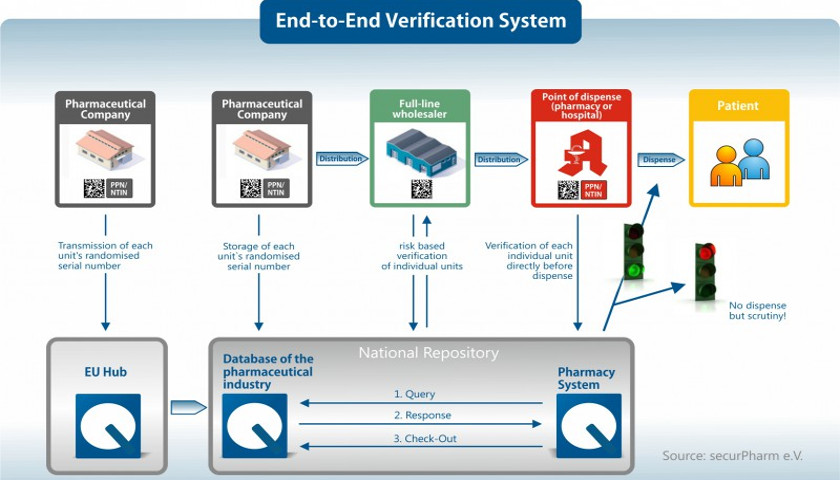
securPharm: Il sistema di verifica nazionale
securPharm: Il sistema di verifica nazionale garantisce medicinali sicuri in Germania
Non appena in farmacia viene scannerizzata la confezione del medicinale, il codice letto viene comparato con un database on-line al fine di verificare che si tratti di un farmaco sicuro legale. Gli stati europei hanno generato rispettivi sistemi nazionali nella propria lingua, nei quali sono registrati i relativi dati. In Germania il sistema funziona con il nome securPharm. Quello usato precedentemente in Germania, di solito un codice identificativo dei farmaci codificato in un codice a barre (PZN), con l'introduzione di securPharm viene acquisito nell'identificatore prodotto NTIN o PPN prescritto dalla direttiva contro la falsificazione europea. Viene registrato, unitamente alle altre necessarie informazioni, nel codice matrice 2D.
Fonte: securPharm e.V.: „Regole per la codifica di medicinali soggetti a controllo nel mercato tedesco“
European Medicines Verification Organisation (EMVO)
Identificazione dei medicinali a livello europeo con l'ausilio dell'EMVO
Dal 2015 i database nazionali vengono composti in un hub europeo. Questo garantisce la comparabilità dei dati a livello Europa, consentendo così il commercio interno europeo per medicinali sicuri. Questo hub UE è sotto la custodia del European Medicines Verification Organisation, in breve EMVO, che sviluppa ulteriormente e gestisce il progetto. I produttori di medicinali forniscono i dati richiesti direttamente al database europeo, che a sua volta comunica con i database nazionali. La struttura dei database nazionali e internazionali dovrebbe dovrebbe essere conclusa entro il 2019, in tempo per l'entrata in vigore della direttiva contro la falsificazione europea.
DSCSA – il Drug Supply Chain Security Act assicura medicinali sicuri negli USA
La direttiva contro la falsificazione DSCSA americana è parte del DQSA (Drug Quality Security Act) dell' FDA. È stata firmata nel 2013 dal Presidente e dovrebbe essere completamente implementata entro il 2023. Produttori e rivenditori di medicinali soggetti a prescrizione o rimborsabili hanno l'obbligo già dal 2015 di mettere a disposizione le necessarie informazioni a livello lotto e di annotare tutti i dati delle transazioni fino all'uscita finale in farmacia. Grazie alla tracciabilità ininterrotta dei numeri lotto dei medicinali possono essere rapidamente rilevati e messi al sicuro lotti di medicinali non solo falsificati, ma anche rubati. A tal fine, per i diversi stakeholder, produttori, fornitori di servizi di confezionamento, grossisti e venditori si applicano scadenze scaglionate. A partire da novembre 2023 l'obbligò verrà esteso alla marcatura del medicinale-confezioni singole. Il termine transitorio per la marcatura di confezioni singole inizierà a novembre 2018. Le relative prescrizioni che prima si applicavano in singoli stati federali adesso verranno sostituite dal regolamento a livello USA.
Avete bisogno di altre informazioni sulla DSCSA?
Il DSCSA impone queste indicazioni
A partire da novembre 2018 su ogni confezione singola dovranno essere indicate in formato di codice matrice 2D e in testo in chiaro le seguenti informazioni:
- identificatore prodotto nazionale in formato GTIN
- numero di serie individuale della confezione singola
- data di scadenza del medicinale
- designazione lotto medicinale
Serializzazione di flaconi HDPE
Serializzazione di flaconi HDPE negli USA
Oltre all'implementazione della direttiva DSCSA, produttori e confezionatori per il mercato statunitense devono fronteggiare altre sfide: i flaconi HDPE per pastiglie e capsule commercializzati negli USA. Al contrario delle comuni astucci con blister usate in Europa, questi hanno requisiti molto diversi per quanto attiene alla logistica produttore. In ciò rientrano anche i cosiddetti helper-code o codici ausiliari. Vengono applicati, per l'aggregazione di flaconi in grandi fardelli, sul coperchio o sul fondo dei flaconi. Ciò può anche essere fatto con inchiostro UV „invisibile“. L'helper-code consente l'identificazione di confezioni, perfino quando le singole etichette dei flaconi non sono più leggibili per via della fardellizzazione.
La serie Bottle di Wipotec stampa e ispeziona in modo affidabile flaconi e fiale. Trovate la vostra soluzione per l'ispezione prodotto, la serializzazione e l'aggregazione semiautomatica affidabili di flaconi e fiale per soddisfare i requisiti della direttiva contro la falsificazione DSCSA americana.
Ispezione completa ultrarapida – serializzazione compatta – Aggregazione semiautomatica>semi-automatic aggregation – stampa di helper-code
Marcatura del medicinale con e-pedigree
Tracciabilità della marcatura del medicinale a livello USA con e-pedigree
L'e-pedigree, in un certo senso è il corrispondente sistema statunitense del sistema EMV europeo. In questo "albero genealogico" sono registrati tutti i dati di un preparato, compresi i dati delle transazioni, che vengono raccolti lungo la catena di fornitura di un medicinale. Anche qui si hanno database su piccola scala a livello di stati federali, che vengono composti in un database internazionale. Molti dei database federali si basano sul sistema della Florida, stato pioniere, che ha introdotto l'e-pedigree già nel 2005.
Direttiva contro la falsificazione in Sudafrica: serializzazione di confezioni secondarie e terziarie
Legge federale 61-FZ: Introduzione di una direttiva contro la falsificazione in Russia
Falsificazione di medicinali ed economia sommersa, in Russia sono un problema grave. In risposta a ciò la Duma 2010 ha adottato la legge 61-FZ per il commercio di farmaci, che dovrebbe contribuire alla sicurezza dei medicinali. Fino alla fine del 2017 c'era un progetto pilota ristretto ad alcune sostanze essenziali, che monitorava la produzione e la catena di fornitura di prodotti farmaceutici venduti nelle farmacie dell'area di Mosca e San Pietroburgo. L'obiettivo era: riconoscere in modo affidabile medicinali falsificati. A partire da gennaio 2020 tutti i medicinali soggetti a prescrizione dovrebbero essere serializzati e aggregati.
Direttiva contro i medicinali falsificati in Brasile: Track & Trace con SNCM
L'autorità sanitaria brasiliana ANVISA costituisce un passo avanti. Nel 2014 ha adottato i regolamenti abbreviati SNCM per un sistema Track & Trace con il quale vengono monitorati produzione e catena di fornitura di medicinali. Come per i sistemi europei ed americani, anche qui sulle confezioni dovrebbero essere stampati identificatore prodotto, numero di serie, numero lotto e data di scadenza dei medicinali. Dopo alcuni ritardi nell'implementazione, l'attuale regolamento valido indica il 1 aprile 2022 quale termine per l'implementazione completa del „Sistema Nacional de Controle de Medicamentos“.

Il Sudafrica si unirà alla lotta globale contro i medicinali falsificati. Considerato che le esportazioni farmaceutiche dall'UE al Sudafrica ammontano a oltre 1 miliardo di euro all'anno, la codifica e le direttive di serializzazione attuali del Sudafrica per i produttori farmaceutici europei significano grande cambiamento. Per soddisfare i requisiti, le società che effettuano forniture al Sudafrica dovranno riorganizzare i propri processi di confezionamento. Le serializzazione di confezioni secondarie e terziarie sarà completata entro il 2022. L'implementazione graduale del regolamento fornirà alle case farmaceutiche tempo sufficiente per prepararsi.
Implementazione delle direttive contro la falsificazione – come la raggiungono confezionatori e professionisti del settore farmaceutico?
Con l'introduzione delle direttive contro la falsificazione, produttori farmaceutici e fornitori di servizi di confezionamento dovranno affrontare grandi sfide, sia di natura tecnica sia per quanto attiene alla mentalità in azienda. Per far fronte a questi ostacoli, Wipotec può contribuire con soluzioni su misura e svariate informazioni. La base innanzitutto, per marcare individualmente non più solo ogni lotto ma ogni singola confezione, spesso rende necessari cambi nella linea di produzione e nuovi acquisti. Produttore e imballatore si devono quindi confrontare con alcune sfide.
Azioni a livello dirigenziale
Scadenze strette richiedono azioni rapide a livello dirigenziale
Nella realtà constatiamo che per più aziende il cambio nella linea di produzione in molti luoghi è più "solo" un problema tecnico che il responsabile produzione è in grado di controllare da solo. Per trovare la soluzione perfetta che si adatti ai requisiti dei paesi di destinazione così come alle condizioni in alcune aziende, spesso sono necessari colloqui con più provider di soluzioni. I produttori conto terzi devono mettersi in contatto tempestivamente con i propri committenti e partner. Questo perché trovare la soluzione migliore spesso richiede tempo - in vista delle scadenze che si avvicinano sempre più rapidamente ciò è un problema per il quale il livello dirigenziale dovrebbe prendere provvedimenti. La sfida è di riconoscere la priorità estremamente alta di queste questioni, riservando a tempo debito sufficiente tempo affinché vengano chiarite. Allo stesso tempo devono essere affrontati più compiti - e ciò non riguarda solo soluzioni variabili per la codifica e la marcatura di confezioni e lotti, ma anche elaborazione e trasferimento dei dati ai database nazionali.
In questo caso le soluzioni di Wipotec offrono un vantaggio decisivo: grazie alle interfacce aperte delle nostre macchine è garantita una compatibilità con soluzioni software di più provider di servizi di Level 3.
Apprendete di più riguardo ai vantaggi delle interfacce XML aperte!
Non potete più aspettare? TQS Fast Track è la soluzione rapida plug-and-play che consente una serializzazione totalmente automatizzata entro 6 settimane!
Qualità di stampa e gestione dei dati
Requisiti di qualità di stampa e gestione dei dati richiedono investimenti
Non dovrebbe neppure essere sottovalutato il relativo onere d'investimento per il reperimento, acquisto e integrazione delle soluzioni adatte. La stampa di confezioni con codici duraturi ad alta risoluzione e scritte la cui lettura da parte della macchina sia sempre garantita non è una sfida da poco. Date le alte velocità, al fine di prevenire una stampa sfocata si rende necessario l'impiego di tecnologie di trasporto dei prodotti adatte. Per garantire la leggibilità delle codifiche per l'intera durata del prodotto devono anche essere assicurate stabilità alla luce e resistenza all'abrasione della stampa su diverse basi. Solo con un alto grado di corrispondenza può essere evitato un fuori-squadro di prodotti da parte dei sistemi di riconoscimento delle immagini In particolare nel caso di codici piccoli ad alta densità, per garantire la necessaria qualità di marcatura ad alta velocità di stampa l'uso di sistemi di trasporto prodotto e di stampa adatti è inevitabile.
Per garantire la conformità alle direttive contro la falsificazione, produttori farmaceutici e fornitori di servizi di confezionamento non dovrebbero partire con il piede sbagliato. Ritorno sull'investimento: commerciabilità continua.
Flessibilità
Un mercato internazionale richiede un alto grado di flessibilità
I produttori che da uno stabilimento forniscono più regioni devono procurarsi la necessaria flessibilità per differenti formati e layout d stampa. Ciò significa anche che la linea di confezionamento e le unità di stampa possano essere rapidamente e senza errori convertite alle rispettive direttive contro la falsificazione. Per ciò i produttori devono creare il record dati individuale per ogni prodotto singolo, caricandolo infine nel rispettivo sistema di database nazionale o internazionale. Le interfacce utente facili da operare delle soluzioni di Wipotec con la funzione software ConfigureFast consentono l'impostazione rapida e senza errori di codici specifici dei Paesi senza ritardo nel corso della procedura operativa. Il software flessibile consente il cambio codice non complicato. Il LineManager integrato prima mantiene tutti i dati di produzione nella memoria tampone locale, poi li trasmette al sistema Level 3 collegato. La memoria temporanea assicura i dati dalla perdita in caso di interruzioni dell'alimentazione di corrente e altre incertezze.
Soluzioni compatte con poco spazio: Track & Trace nel Fast Track
Nelle linee di produzione e confezionamento di produttori farmaceutici e confezionatori conto terzi, spesso lo spazio libero è scarso. Le macchine molto compatte di Wipotec facilitano l'integrazione di importanti funzioni nelle linee esistenti in minimo spazio. Il meglio: la serializzazione entro solo 6 settimane con le nostre soluzioni Fast Track.
La TQS-SP consente la serializzazione e l'etichettatura antimanomissione (tamper evident) di singole confezioni di medicinali in uno spazio estremamente contenuto. La TQS-HC-A con Tamper Evident consente di assolvere automaticamente a tre compiti su una lunghezza di 1800 mm: selezione ponderale, serializzazione ed etichettatura.
I vantaggi per l'utente:
- Conformità affidabile alle direttive contro la falsificazione internazionali
- Anche quando lo spazio disponibile è poco
- Soluzione entro sei settimane dall'ordine
- Modulari, scalabili e facilmente integrabili in linee esistenti
Informatevi adesso sulle soluzioni di serializzazione più compatte per il mercato UE!
It’s worth seeing the international falsification directives as an opportunity to optimise your business performance and contribute to patient protection.
- Full compliance with the FMD will guarantee your continued marketability.
- You’ll be one step ahead of your competitors due to your flexibility with our solutions.
- The traceability of products required by the falsification directives will provide you with valuable Track & Trace data on the efficiency of your supply chain and sales – allowing you to control and optimise your operations.
Find the right solution for your application now!
Successful solutions for the pharmaceutical industry: Find out more about customer projects with Wipotec.



![[Bitte in "Italiano" übersetzen:] TQS-CP for semi-automatic aggregation of drugs [Bitte in "Italiano" übersetzen:] TQS-CP drug aggregation](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-cp-aggregation-drugs.jpg)


![[Bitte in "Italiano" übersetzen:] Product identification number PPN [Bitte in "Italiano" übersetzen:] Product identification number PPN](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/pharmaceutical-product-identification-number-ppn.jpg)

![[Bitte in "Italiano" übersetzen:] TQS-SP: User-friendly serialisation in the smallest of spaces [Bitte in "Italiano" übersetzen:] TQS-SP: User-friendly serialisation](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-sp-user-friendly-serialisation.jpg)
![[Bitte in "Italiano" übersetzen:] TQS-HC-A: Serialisation, weight inspection and tamper-evident [Bitte in "Italiano" übersetzen:] TQS-HC-A: Serialisation, weight inspection, tamper-evident](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-hc-a-tamper-evident.jpg)